Η ΣΥΜΒΟΛΗ ΤΟΥ ΒΙΟΛΟΓΙΚΟΥ ΡΟΛΟΓΙΟΥ ΣΤΗΝ ΕΥΡΥΘΜΗ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΟΡΓΑΝΙΣΜΟΥ
Εισαγωγή
Στον οργανισμό υπάρχει ένα ενδογενές σύστημα το κιρκάδιο ρολόι (circadian rhythm), το οποίο εντοπίστηκε για πρώτη φορά στα κυανοβακτήρια (Xin et al. 2023), συμβάλλει σε πολλές βιολογικές λειτουργίες για την εύρυθμη λειτουργία του οργανισμού και την διατήρηση της ομοιόστασης (η ιδιότητα του οργανισμού να διατηρεί σταθερές τις εσωτερικές του συνθήκες) (Yeliz, Nilüfer 2019; Clayton, Jennifer, Kayla 2021) . Το ρολόι αυτό δρα κυκλικά κάθε 24 ώρες και επαναλαμβάνεται διαρκώς, δημιουργώντας μια αρμονικά συντονισμένη κίνηση (ταλάντωση) τον κιρκάδιο ρυθμό (Yeliz, Nilüfer 2019) . Το κιρκάδιο ρολόι ρυθμίζεται από εξωγενείς παράγοντες του περιβάλλοντος όπως είναι ο κύκλος φωτός-σκότους.
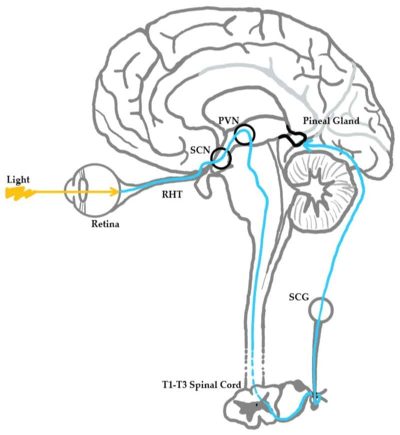
Ο κεντρικός πυρήνας του ρολογιού είναι ο υπερχιασματικός πυρήνας (SCN suprachiasmatic nuclear) όπου εδράζεται στον υποθάλαμο του εγκεφάλου και αποτελείται περίπου από 20.000 νευρώνες (Clayton, Jennifer, Kayla 2021)και τα περιφερειακά κιρκάδια ρολόγια που βρίσκονται στους διάφορους ιστούς (Aarti et al. 2017). Η απορρύθμιση του οφείλεται συνήθως στην έκθεση στο μπλε φως (blue light), μέρος του φωτός των οθονών των τεχνολογικών συσκευών, στις βραδινές βάρδιες (night shifts), στην πρόσληψη καφεΐνης τις βραδινές ώρες και το ‘jet lag’ και οδηγούν σε αρνητικές επιδράσεις στην φυσιολογία του (Clayton, Jennifer, Kayla 2021; Carolin, Tom, Hans 2022).
Η επίδραση του φωτός στην αφύπνιση του οργανισμού
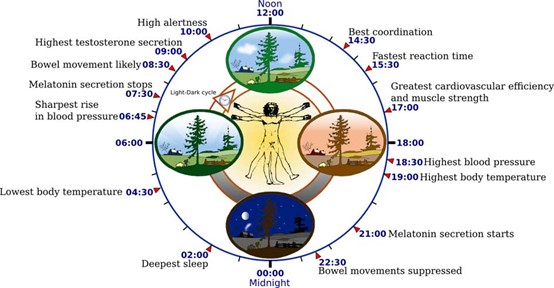
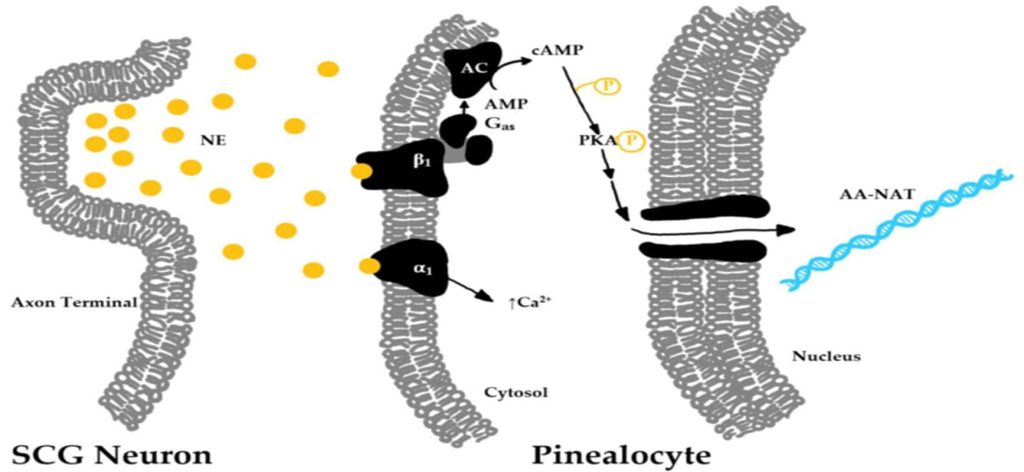
Η κορτιζόλη ή αλλιώς ορμόνη του στρες είναι η υπεύθυνη ορμόνη για την αφύπνιση του οργανισμού, καθώς διεγείρει την γλυκόλυση την λιπόλυση και την πρωτεόλυση διάσπαση (των κύριων καυσίμων του σώματος) ώστε να υπάρχουν διαθέσιμες πηγές ενέργειας (Yeliz, Nilüfer 2019) . Οι συγκεντρώσεις της κορτιζόλης κορυφώνονται κατά την αφύπνιση και κατά την διάρκεια της ημέρας ελαττώνεται φτάνοντας στην πιο χαμηλή συγκέντρωση λίγο μετά τα μεσάνυχτα (Yeliz, Nilüfer 2019) . Όταν εισέρχεται φως μέσα από τον αμφιβληστροειδή χιτώνα, αυτό ανιχνεύεται από φωτοευαίσθητα γαγγλιακά κύτταρα του αμφιβληστροειδούς (ipRGCs photosensitive retinal ganglion cells) (Clayton, Jennifer, Kayla 2021) και μεταφέρεται σήμα στον υπερχιασματικό πυρήνα ο οποίος έπειτα διεγείρει την έκκριση γ-αμινοβουτυρικού οξέος (GABA) το οποίο δεσμεύεται σε υποδοχείς καταστολής των νεύρων του PVN (paraventricular nucleus) και διακόπτεται η μετάδοση σήματος προς την επίφυση για την παραγωγή μελατονίνης (Josephine et al. 2022).
Ως συνέπεια αυτών των γεγονότων είναι οι έκφραση των γονιδίων των μεταγραφικών παραγόντων Per1 (Period 1) και Per2 (Period 2) και Sik1 (salt inducible kinase 1) (Aarti et al. 2017) ώστε να συντεθούν τα αντίστοιχα πρωτεϊνικά τους μόρια τα οποία έπειτα θα διεγείρουν, με κυκλικές κινήσεις ενεργοποίησης-καταστολής την μεταφορά σήματος στα περιφερειακά ρολόγια. Αυτό γίνεται με την απελευθέρωση νευροδιαβιβαστών (επινεφρίνης και νορεπινεφρίνης) στις νευρικές απολήξεις του αυτόνομου νευρικού συστήματος (συμπαθητικό και παρασυμπαθητικό σύστημα) και την έκκριση γλυκοκορτικοειδών και αδρεναλίνης από την υπόφυση (Shang-Chun 2018). Στη συνέχεια εκφράζονται τα κύρια γονίδια CLOCK (Circadian Locomotor Output Cycles Kaput) και BMAL1 (Brain muscle arnt-like 1) στα περιφερειακά ρολόγια κάθε κυττάρου οδηγώντας στην διατήρηση της ομοιόστασης του οργανισμού (Aarti et al. 2017; Shi-Cong, Shang-Chun 2018).
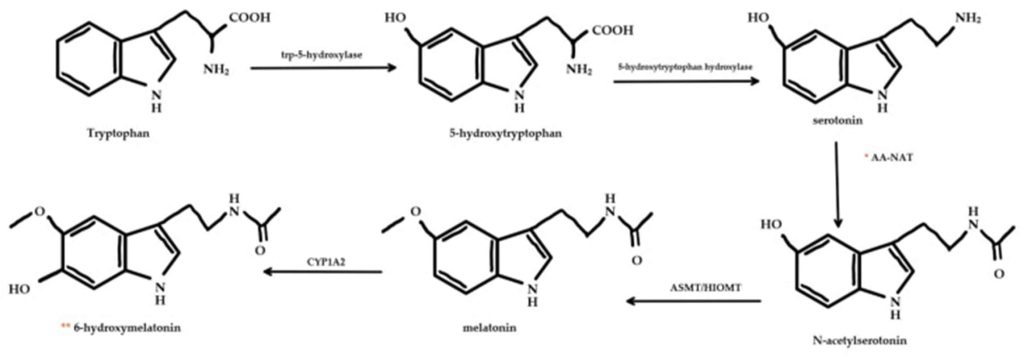
Η σημασία της φυσιολογίας του ύπνου
Ο ύπνος αποτελεί αναπόσπαστο κομμάτι της καθημερινότητάς μας καθώς ρυθμίζει τον κιρκάδιο ρυθμό. Οι ενήλικες προτείνεται να κοιμούνται 7-8 ώρες και οι έφηβοι τουλάχιστον 9 ώρες (Clayton, Jennifer, Kayla 2021). Η ορμόνη που ρυθμίζει τον ύπνο είναι η μελατονίνη με χαρακτηριστική ομάδα της ινδόλης (εικόνα 3) που προέρχεται από τον νευροδιαβιβαστή σεροτονίνη (Josephine et al. 2022; Clayton, Jennifer, Kayla 2021). Η μελατονίνη συντίθεται στην επίφυση (εικόνα 4), η έκκριση της διεγείρεται από την εξασθένηση του φωτός, μεταφέρεται σήμα μέσω της πορείας που περιγράφεται εικόνα 2 από τα φωτοευαίσθητα κύτταρα (Clayton, Jennifer, Kayla 2021). Με τον τρόπο αυτό επιτρέπεται η έκκριση γλουταμινικού ενεργοποιώντας την μετάδοση σήματος από το PVN έως την επίφυση (Josephine et al. 2022). Η συγκέντρωση της μελατονίνης αυξάνεται σταδιακά στις 11:00 μ.μ. και να κορυφώνεται στις 5:00 π.μ. φτάνοντας, δέκα φορές μεγαλύτερη συγκέντρωση στο πλάσμα του αίματος από το φυσιολογικό (Yeliz, Nilüfer 2019).
Πως επιδρά η απορρύθμισή του κιρκάδιου ρυθμού
Ο σύγχρονος τρόπος ζωής αποτελεί αιτία απορρύθμισης του κιρκάδιου ρυθμού. Οι κύριοι παράγοντες απορρύθμισης είναι:
α) έκθεση στο μπλε φως των οθονών των τεχνολογικών συσκευών που τον επηρεάζουν λόγω του χαμηλού μήκος κύματος (460nm) την μελατονίνη, μειώνοντάς τον ρυθμό έκκρισής της (Clayton, Jennifer, Kayla 2021),
β)η υπερβολική πρόσληψη καφέ οδηγεί σε ελλειμματική έκκριση μελατονίνης καθώς η καφεΐνη συνδέεται με τους αδρενοσυνεργικούς υποδοχείς A1 και A2 προτού την αδενοσίνη και αναστέλλει την γλουταμινικού από το SCN ώστε να μεταφερθεί σήμα στο PVN μέχρι την επίφυση για την παραγωγή μελατονίνης (Carolin, Tom, Hans-Peter 2022),
γ)οι βραδινές βάρδιες οι οποίες δρουν με τον ίδιο τρόπο λόγω έκθεσης σε φως μικρού κύματος τις βραδινές ώρες και (Clayton, Jennifer, Kayla 2021)
δ)το συνεχές jet lag που συμβαίνει όταν ταξιδεύουμε σε άλλες χώρες όπου ο χρονικές περίοδοι διαφέρουν σε σύγκριση με την αρχική χώρα (Tyler et al. 2021).
Οι παράγοντες αυτοί οδηγούν σε διαταραχές της ομοιόστασης του οργανισμού έχοντας αρνητικές επιδράσεις στην φυσιολογία του οργανισμού.
Συνεχείς διαταραχές του φυσιολογικού ημερήσιου ρυθμού που οφείλεται στην έλλειψη ύπνου ή λανθάνουσας ρουτίνας ύπνου και αφύπνισης είναι υπεύθυνες για την χρόνια κόπωση, το άγχος, την κατάθλιψη και την απώλεια συγκέντρωσης με αποτέλεσμα να μην είμαστε παραγωγικοί στην εργασία μας όσο θα επιθυμούσαμε (Yeliz, Nilüfer 2019). Επιπλέον, η απορρύθμιση αυτή είναι υπεύθυνη για διαταραχές του γαστρεντερικού συστήματος καθώς επίσης αυξάνονται τα ποσοστά απόκτησης παχυσαρκίας λόγω απορρύθμισης της λεπτίνης και της ορεξίνης. Ακόμη εμφανίζεται αυξημένη προδιάθεση για καρκίνο και ισχυρή συσχέτιση νευροεκφυλιστηκών νόσων, όπως η νόσος Huntington, Parkinson και το Alzheimer. Και στις τρεις αυτές περιπτώσεις παρατηρείται σταθερά χαμηλή συγκέντρωση μελατονίνης και καθυστέρηση της φάσης ύπνου λόγω μείωσης της μελατονίνης καθώς επίσης και αλλαγές στα γονίδια CLOCK και BMAL1 (Tyler et al. 2021).
ΓΛΩΣΣΑΡΙ
Ομοιόσταση: η ιδιότητα του οργανισμού να διατηρεί σταθερές τις εσωτερικές του συνθήκες
SCN: suprachiasmatic nucleus υπερχιασματικός πυρήνας εδράζεται στον εγκέφαλο
ipRGCs: intrinsically photosensitive retinal ganglion cells φωτοευαίσθητα γαγγλιακά κύτταρα του αμφιβληστροειδούς δέχονται ερεθίσματα από το φως και στον αμφιβληστροειδή χιτώνα του ματιού
GABA: gamma-amino butyric acid γ-αμμινοβουτυρικού οξύ σηματοδοτικό μόριο
Επίφυση: βρίσκεται στο πίσω μέρος του εγκεφάλου και κύριος ρόλος της είναι η παραγωγή μελατονίνης
Γονίδιο: περιοχή του γενετικού υλικού (DNA) υπεύθυνο για διάφορες λειτουργίες του των κυττάρων και κατ’ επέκταση του οργανισμού
PER1: Period 1 (γονίδιο)
PER2: Period 2 (γονίδιο)
CLOCK: Circadian Locomotor Output Cycles Kaput (γονίδιο)
BMAL1: Brain muscle arnt-like 1 (γονίδιο)
Αυτόνομο νευρικό σύστημα: αποτελείται από νευρώνες που λειτουργούν ακούσια
Γλυκοκορτικοειδοί: ορμόνη
Αδρεναλίνη: ορμόνη
Μελατονίνη: ένωση-ορμόνη υπεύθυνη για την προαγωγή του ύπνου
Τρυπτοφάνη: αμινοξύ
Σεροτονίνη: ορμόνη χαράς, σηματοδοτικό μόριο και ένωση που προέρχεται από την τρυπτοφάνη (συμβαίνει στην επίφυση)
Γλουταμινικό: αμινοξύ-σηματοδοτικό μόριο
AA–NAT: arylalkylamine-N-acetyltransferase αρυλαλκιλαμμίνη-Ν-ακετυλοτρανσφεράση
Επινεφρίνη: σηματοδοτικό μόριο
Νορεπινεφρίνη: σηματοδοτικό μόριο
α1-αδρενεργικός υποδοχέας: περιοχή σύνδεσης των σηματοδοτικών μορίων νορεπινεφρίνης
β1-αδρενεργικός υποδοχέας: περιοχή σύνδεσης των σηματοδοτικών μορίων νορεπινεφρίνης
Α1-αδρενοσυνεργικός υποδοχέας: περιοχή σύνδεσης των σηματοδοτικών μορίων αδενοσίνης και καφεΐνης
Α2-αδρενοσυνεργικός υποδοχέας: περιοχή σύνδεσης των σηματοδοτικών μορίων αδενοσίνης και καφεΐνης
ΒΙΒΛΙΟΓΡΑΦΙΑ
Science education (2012). National Institute of General Medical Sciences Tick Tock: New Clues About Biological Clocks and Health. Available at: https://nigms.nih.gov/education/Inside-Life-Science/Pages/Tick-Tock-New-Clues-About-Biological-Clocks-and-Health.aspx [Accessed: November 1, 2012]
Aarti Jagannath, Lewis Taylor, Zeinab Wakaf, Sridhar R Vasudevan, Russell G Foster (2017). The genetics of circadian rhythms, sleep and health. Human Molecular Genetics, Volume 26, Issue R2, ( 01 October 2017) Pages R128–R138 available at: https://doi.org/10.1093/hmg/ddx240 [Accessed: 14 July 2017]
Clayton Vasey, Jennifer McBride, and Kayla Penta (2021). Circadian Rhythm Dysregulation and Restoration: The Role of Melatonin. Nutrients (2021), 13 (10), 3480. South Dartmouth MDText.com, Inc.; 2000-2023. Available at: https://doi.org/10.3390/nu13103480 [Accessed: 30 October 2021]
Josephine Arendt (2022) Feingold KR, Anawalt B, Blackman MR, et al., editors. South Dartmouth. Physiology of the Pineal Gland and Melatonin. ENDOTEXT available at: https://www.ncbi.nlm.nih.gov/books/NBK550972/ [Accessed: October 30, 2022]
Carolin Franziska Reichert, Tom Deboer, Hans-Peter Landolt (2022). Adenosine, caffeine, and sleep-wake regulation: state of the science and perspectives. Journal of sleep research Volume 31, Issue 4. Available at: https://doi.org/10.1111/jsr.13597
[Accessed: 16 May 2022]
Shi-Cong Tao Shang-Chun Guo (2018). Extracellular Vesicles: Potential Participants in Circadian Rhythm Synchronization. International Journal of Biological Sciences 14(12):1610-1620. Available at: https://www.ijbs.com/v14p1610.htm [Accessed: September 7, 2018]
Tyler A. Steele, Erick K St Louis, Aleksandar Videnovic, and R. Robert (2021). Circadian Rhythm Sleep-Wake Disorders: a Contemporary Review of Neurobiology, Treatment, and Dysregulation in Neurodegenerative Disease. Neurotherapeutics 18, 53-74 (2021). Available at: https://doi.org/10.1007/s13311-021-01031-8 [Accessed: 12 April 2021]
Xin Wang, Yu-Ting Dong, Xiu-Ming Hu, Ji-Zhou Zhang, Nan-Rui Shi, Yan-Qin Zuo and Xu Wang (2023). The circadian rhythm of extracellular ATP. Purinergic Signalling 19, 283-295 (2023). Available at: https://doi.org/10.1007/s11302-022-09881-3 [Accessed: 24 June 2022]
Yeliz Serin , Nilüfer Acar Tek (2019). Effect of Circadian Rhythm on Metabolic Processes and the Regulation of Energy Balance. Annals of Nutrition and Metabolism Vol. 74, No. 4 (2019). Available at: https://doi.org/10.1159/000500071 [Accessed: 23 April 2019]